PACE
Le projet PACE fait actuellement l’objet d’un développement non clinique. le premier essai clinique chez l’homme portera sur le « traitement des ulcères de jambe drépanocytaires invétérés ».
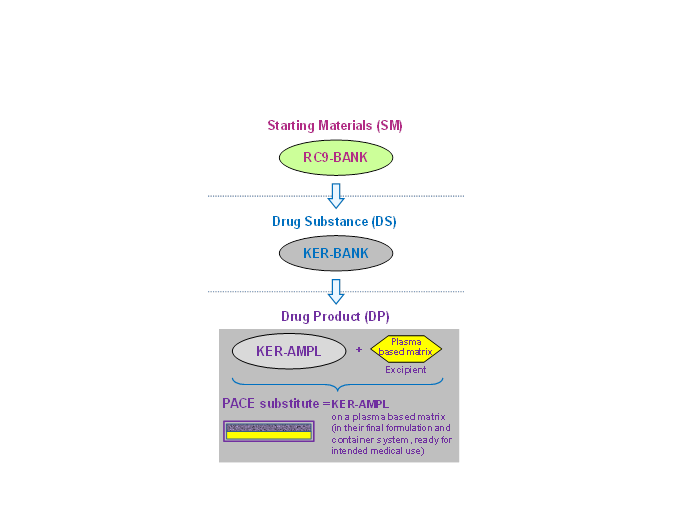
Le produit pharmaceutique consiste en des kératinocytes amplifiés déposés sur une matrice à base de plasma (excipient). Les kératinocytes sont dérivés d’une lignée de CSEh : les RC-9 .
Les RC-9 ont été amplifiées et mises en banque pour constituer une banque de cellules congelées : la RC9-BANK, qui est un matériau de départ (MD). Les RC-9 sont ensuite différenciées en kératinocytes, qui sont amplifiés pour constituer un stock de cellules congelées : le KER-BANK, qui est la substance médicamenteuse.
Le premier essai clinique chez l’homme (PASS-ES) est prévu pour le début de l’année 2025 : « Sécurité, tolérance et efficacité d’un substitut d’épiderme dérivé de cellules souches embryonnaires humaines pour le traitement des ulcères de jambe drépanocytaires invétérés : Un premier essai chez l’homme, multicentrique, de phase I/II ».
L’essai sera mené dans quatre centres dermatologiques de la région parisienne (Ile de France) qui traitent la plupart des ulcères de jambe drépanocytaires. Ces quatre centres sont représentatifs de la population atteinte de drépanocytose car la moitié des naissances de patients drépanocytaires ont lieu dans la région parisienne.
Un centre supplémentaire est en cours d’évaluation dans le département de la Guadeloupe, car ce site draine le plus grand nombre de patients atteints d’ulcères de jambe liées à la drépanocytose de la zone Caraïbe française.
Dernière mise à jour :
- Lot de développement de kératinocytes : prêt
- Études non cliniques en cours
- Le premier lot d’IMP clinique devrait être produit au 4ème trimestre 2024
- La demande d’autorisation d’essai clinique est prévue pour le T3 2024
- Le recrutement du premier patient est prévu pour Q12025