STREAM
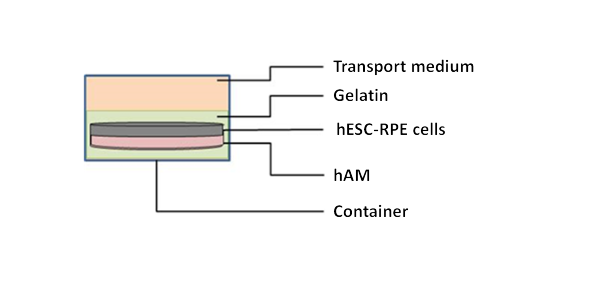
Étude de phase I/II, ouverte, sur l’innocuité, la tolérance et l’efficacité préliminaire de l’implantation dans un œil de cellules de l’épithélium pigmentaire rétinien (RPEs) dérivées de cellules souches embryonnaires humaines (hESC) chez des patients atteints de rétinite pigmentaire due à une mutation monogénique.
Localisation
France : Centre Hospitalier National d’Ophtalmologie (CHNO) des Quinze-Vingts.
Résumé
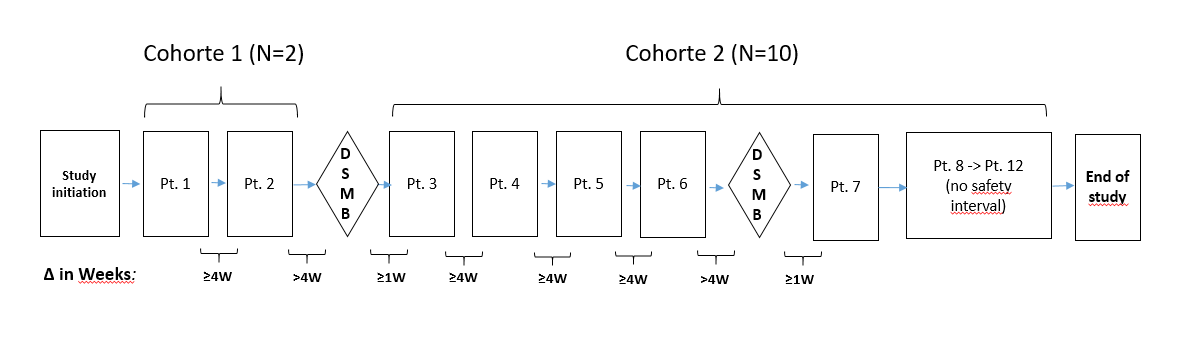
Étude non randomisée, assignation d’un seul groupe de patients consistant en 2 cohortes séquentielles :
- Première cohorte de 2 patients présentant une perte d’acuité visuelle très avancée (légalement aveugles)
- Deuxième cohorte de 10 patients présentant une perte d’acuité visuelle moins avancée.
Au total, 12 patients évaluables recrutés et répartis dans les deux cohortes décrites ci-dessus.
Le suivi prévu pour un patient est d’environ 64 semaines, dont 8 semaines de screening et une période de suivi de 56 semaines après l’implantation de RPEs dérivées de hESC.
Après 56 semaines de suivi, les patients seront suivis à long terme pendant 4 années supplémentaires.
L’objectif principal est d’évaluer la sécurité et tolépérabilité de l’implantation du produit médicinal de recherche (ISTEM-01) chez les patients atteints de rétinite pigmentaire.
Critères d’évaluation principaux
La sécurité et la tolérabilité, mesurées par l’incidence des événements indésirables (EI) ou des événements indésirables graves (EIG), évaluées par les changements dans les examens ophtalmologiques, les paramètres de laboratoire, les signes vitaux et l’examen physique entre le début de l’étude et chaque visite, seront évaluées pour chaque patient sur une période de 56 semaines.
- Date effective de début de l’étude : 19 août 2019
- Date d’achèvement primaire estimée : 15 août 2023
- Date d’achèvement estimée de l’étude : 15 décembre 2026
Dernière mise à jour : l’inclusion dans l’étude est terminée en janvier 2023. 8 patients ont été inclus et 7 patients ont été traités.